آنزيم های غذايی در صنعت مرغداری(بخش چهارم)
عناوین این مطلب
شناخت آلفا آميلازها و تاثیر آن ها بر محیط
اين آنزيم به ميزان وسيعي در گياهان و حيوانات وجود دارد و هر مولكول آن داراي يك گرم كلسيم مي باشد . آلفا آميلاز آنزيمي است داخلي و به طور تصادفي اتصالهاي 4 , 1-α را مي شكند و آميلوپكتين را به اليگو سا كاريدهايي كه داراي 6 – 2 ملكول گلوكز هستند تبديل مي كند به اين ترتيب مي تواند ويسكوزينه ايجاد شده توسط آميلوپكتين در محيط را كاهش دهد و محيط را رقيق نمايد.از همين نظر است كه به آن آنزيم مايع كننده Liquifying Enzyme نيز گفته مي شود.با انجام عمل مالت سازي روي دانه هايي مثل جو مي توان مقدار اين آنزيم را به ميزان بسيار زيادي افزايش داد.
از چنين مالتي كه سرشار از اين آنزيم است مي توان براي مصارفي چون توليد نان كه نيازمند فعاليت آلفا – آميلاز براي فراهم ساختن قندهاي قابل استفاده براي مخمر مي باشد ، بهرمند شد.البته در مورد گندم ، توليد يا وجود آلفا – آميلاز زياد ، نامطلوب است زيرا باعث ايجاد مقادير زيادي گاز در جريان توليد نان مي شود .اما در مورد گندمهايي كه مثل گندمهاي آمريكايي شمالي اساسا داراي آلفا – آميلاز كمي هستند به كارگيري اين آنزيم مي تواند سودمند باشد .آلفا – آميلازي كه در صنعت مورد استفاده قرار مي گيرد اكثرا با باسيلوس لي چني فورميس Bacillus licheniformis يا اسپرژيلوس اريزه Aspegillus oryzae به دست مي آيد.
شناخت بتا آميلازها و کاربرد آن ها
اين آنزيم يك آنزيم خارجي يا انتهايي است.به اين معني كه از انتهاي غير احياء كننده نشاسته ، ملوكولهاي گلوكز را به صورت دوتايي يعني مالتوز جدا مي كند.اما عمل آن وقتي كه به اتصا ل6 , 1-α مي رسد متوقف مي گردد.اين آنزيم فقط در گياهان عالي وجود دارد.محصول بدست آمده از آن قابل استفاده براي مخمر است از اين نظر از مالت جو و گندم كه مقادير قابل توجهي از اين آنزيم را دارند مي توان استفاده كرد .در اينجا بايد توجه شود كه در جريان اين تبديل ، شكل آلفا – مالتوز تبديل به شكل بتا مي گردد .
شناخت گلوكوآميلاز و موارد استفاده آن
گلوكوآميلاز Glucoamylase . گلوكوآميلاز نيز يك آنزيم خارجي است كه از انتهاي غير احياء كننده ملكول ، گلوكز را به شكل پي در پي جدا مي كند . اين آنزيم قادر به شكستن پيوند 6 , 1-α مي باشد با اين تفاوت كه اين كار را نسبت به شكستن پيوند 4 , 1-α با سرعت كمتري انجام مي دهد . از اين نظر است كه محصول نهايي آن گلوكوز مي باشد .منابع توليد اين آنزيم ، اسپر ژيلوس نيژر و اسپر ژيلوس اريزه هستند . از اين آنزيم براي توليد شربت ذرت و گلوكز از آن استفاده مي شود . يك مشكل كه در تبديل نشاسته ذرت به گلوكز مشاهده مي گردد ، وجود آنزيم ترانس گلوكوزيداز Transglucoxidase است كه در جريان تهيه آلفا – آميلاز و گلوكو آميلاز به وجود مي آيد. زيرا اين آنزيم از گلوكز ، اوليگوسا كاريدهايي را توليد مي كند و از اين طريق بازده عمليات را كاهش مي دهد .به طور كلي بايد توجه داشت كه براي آنكه تجزيه نشاسته به خوبي و به شكل كاملي صورت گيرد بايد قبلا عمل ژلاتيني شدن آن انجام گرفته باشد.
شناخت بتا گلاكتوزيداز و موارد استفاده آن
بتا – گلاكتوزيداز ß-galactossidase . اين آنزيم در گياهان ، حيوانات باكتريها و مخمرها وجود دارد.يك كار مهم و مشخص اين آنزيم تجزيه لاكتوز است ، و از همين نظر است كه به لاكتاز نيز معروف مي باشد.همان طور كه قبلا اشاره شد ، مصرف شير به دليل وجود لاكتوز در آن براي برخي افراد با مسائل گوارشي همراه است. علت اين وضع ، فقدان همين آنزيم لاكتاز در اين افراد مي باشد . اين آنزيم را مي توان از آسپرژيلوس نيژر ، آسپرژيلوس اريزه و برخي ساكاروميسس ها Saccharomyces به دست آورد.شكل تثبيت شده آن نيز امروزه به طور موفقيت آميزي مورد استفاده قرار مي گيرد.
شناخت پروتئازها و اهمیت بسیار آن ها در صنایع غذایی
پروتئازها نيز نظير آميلازها شامل دو گروه اصلي خارجي Exopeptidases و داخلي Endopeptidases مي باشند.انواع خارجي خود دو دسته هستند .يكي كربوكسي پپتيدازها كه پيوند پپتيدي اسيدهاي آمينه اي را كه در انتهاي c زنجيره پپتيدي قرار گرفته اند مي شكنند و دسته ديگر آمينوپپتيدازها كه اسيدهاي آمينه موجود در انتهاي N را جدا مي كنند پروتئازهاي داخلي پيوندهاي مختلفي را در داخل زنجيره پپتيدي مي شكنند و در اين رابطه عملكردي اختصاصي دارند.اين كه كدام پيوند پپتيدي توسط يك آنزيم خاص داخلي شكسته مي شود بستگي به گروه R اسيدهاي آمينه اي دارد كه در طرفين پيوند مربوط قرار گرفته اند.زيرا براي شكسته شدن پيوند بايد اسيدهاي آمينه طرفين آن در قسمت محل فعال آنزيم به شكل مناسبي قرار بگيرند تا اين عمل انجام شود .ازاين نظر لازم است كه گروههاي R اين اسيدهاي آمينه از وضعيت ساختماني خاصي برخوردار باشند .پروتئازها در فرايندهاي متابوليك و در صنايع غذايي داراي اهميت زيادي هستند كه در زير انواع مهمي از آنها مورد بحث قرار مي گيرند.
شناخت رنین و نحوه به دست آوردن آن
رنين Rennin.رنين شكل خالص آنزيم موجود در رنت Rennet يا مايه پنير است كه در پنير سازي از آن استفاده مي شود .اين آنزيم از معده چهارم گوساله شير خوار , تا وقتي كه از علف تغذيه نمي كند , استخراج مي گردد.پس از آنكه گوساله شروع به مصرف علف مي كند به جاي رنين ، پپسين Pepsin ترشح مي شود.اين آنزيم به حالت غير فعال ، به نام پرورنين Prorennin ترشح مي گردد.ماده استخراج شده از معده خشك شده ، هم داراي رنين و هم داراي پرورنين مي باشد .تبديل پرورنين به رنين با افزودن اسيد تسريع مي گردد.اين فرايند به صورت اتوكاتاليتيك است ، يعني با توليد مقداري رنين ، اين ماده بقيه پرورنين را به رنين فعال تبديل مي كند .پپسين نيز مي تواند كار تبديل پرورنين به رنين را انجام دهد .عمل تبديل پرورنين به رنين همراه با آزاد شدن پپتيدهايي از قسمت انتهاي N ملكول پرورنين مي باشد كه طي آن وزن ملكولي از 36000 به 31000 كاهش مي يابد.سه پيوندي دي سولفيد قسمتهاي مختلف پرورنين را به هم متصل مي كنند كه بعد از تبديل به رنين نيز بدون تغيير باقي مي ماند .PH مناسب براي فعاليت رنين 5/3 است اما بيشترين پايداري آن در PH 5 مشاهده مي شود.توليد پنير در PH 5/6 – 5/5 صورت مي گيرد.
انعقاد شير توسط رنين طي دو مرحله انجام مي شود.در مرحله اول كه آنزيمي است آنزيم روي كاپا – كازئين كه داراي 169 اسيد آمينه مي باشد اثر مي كند و پيوند ميان فنيل آلانين و متيونين را كه به ترتيب اسيدهاي آمينه شماره 105 و 106 در اين پروتئين هستند ، مي شكند .به دنبال اين ، اثر حفاظت كننده كاپا – كازئين روي – كازئين از بين مي رود . در مرحله دوم كه غير آنزيمي است ، كازئين تغيير يافته ، تحت اثر يون كلسيم رسوب مي كند .ساير آنزيمهاي تجزيه كننده پروتئين ، نظير پپسين و پروتئازهاي ميكروبي نيز مي توانند همان پيوند ذكر شده را بشكنند.
پپسين . پپسين در مخاط پوششي سطح معده توليد مي گردد.اين آنزيم نيز به صورت غير فعال موسوم به پپسينوژن Pepsinogen ساخته مي شود كه در PH پايين معده به پپسين فعال تبديل مي گردد.اين تبديل هم كه اتوكاناليتيك است با جداشدن چندين پپتيد كوچك از قسمت انتهاي N ملكول پپسين انجام مي گيرد .اين پپتيدهاي كوچك كه به صورت غير كوالان به پپسينوژن اتصال دارند به منزله يك جلوگيري كننده از فعاليت آن عمل مي كنند .اما در PH 2 – 1 در معده از پپسينوژن جدا مي شوند و پپسين توليد مي گردد.پپسين از 321 اسيد آمينه تشكيل شده است .در تبديل پپسينوژن به پپسين ، PH ايزوالكتريك از 7/3 به 1 تنزل پيدا مي كند .ساختمان نوع سوم در پپسين به وسيله سه پيوند سولفيد و يك پيوند فسفاتي پايدار شده است.پپسين در PH بيشتر از 5 دناتوره مي شود و فعاليت خود را از دست مي دهد .اين آنزيم ترجيحا اتصالهاي مجاور فنيل آلانين ، تيروزين و تريپتوفان را مي شكند.
به طور كلي از بعضي از پروتئازهاي كه در PH پايين و اسيدي عمل مي كنند (نظير پپسين ) در توليد پنير استفاده مي شود.اما كيفيت پنير توليدي به خوبي پنير توليد شده توسط رنين نيست و پپتيدهاي تلخ مزه اي ممكن است تشكيل شوند و مسئله ساز باشند.اين گونه پروتئازها همچنين از بعضي ميكروارگانيسم ها نظير موكورپوسيلوس Mucor pusillus به دست مي آيند.در زمينه استفاده از پروتئازها ميكروبي در توليد پنير در ساليان اخير پيشرفتهاي در خور توجهي صورت گرفته است . در تهيه سوس سويا و ميزو Miso (غذايي تخميري از سويا كه در شرق آسيا مصرف مي شود ) نيز از پروتئاز ميكروبي (آسپرژيلوس اريزه) استفاده مي شود.
تريپسين و كيموتريپسين Chymotrypsin .اين دو آنزيم از پانكراس در روده ترشح مي شوند .تريپسين پيوند پپتيدي تشكيل شده توسط گروه كربوكسيل اسيدآمينه ليزين يا آرژنين با ساير اسيدهاي آمينه را مي شكند .كيموتريپسين در واقع شامل چندين نوع آنزيم نسبتا شبيه هم است كه با پيشوند آلفا بتا ، گاما ، دلتا و پي مشخص مي شوند . اينها پيوند مجاور اسيدهاي آمينه تيروزين ، فنيل آلانين و تريپتوفان را مي شكنند و PH مناسب براي فعاليت آنها حدود 8 مي باشد .
تريپسين و كيموتريپسين نيز به صورت غير فعال موسوم به تريپسينوژن و كيموتريپسينوژن توليد مي شوند كه پس از انجام اندكي هيدروليز روي اين شكل غير فعال آنزيم و توليد مقدار كمي از آنزيم به صورت فعال ، واكنش به طور اتوكاتاليتيك ادامه مي يابد و تمام آنزيم به شكل فعال تبديل مي گردد.اين آنزيمها در محل فعال خود داراي اسيد آمينه سرين هستند.بنابراين هر تركيبي كه بتواند با عامل هيدروكسيل سرين وارد واكنش شود سبب جلوگيري از اثر اين آنزيمها مي شود.
كاتپسين ها . اين گروه شامل چند نوع آنزيم است كه از نقطه نظر تجزيه پروتئينها تفاوتهايي با يكديگر دارند . اينها در ليزوزومهاي Lysosomes سلولي قرار گرفته اند و از بقيه پروتئازها مثل تريپسين كه توسط سلول به خارج ترشح مي گردند قابل تشخيص مي باشند.اين آنزيمها در دوران حيات حيوان نقش چنداني ايفا نمي كنند و مي توان گفت حالت مهار شده اي در ليزوزوم دارند.اما پس از مرگ فعاليت مشخصي از خود ظاهر مي سازد و همان طور كه در مبحث پروتئين اشاره شد در عمل ترد شدن گوشت بعد از كشتار وجمود نعشي شركت مي كنند .اين آنزيمها احتمالا بعد از مرگ از ليزوزومها رها مي شوند و باعث تجزيه ميوفيبريلها در داخل سلول ماهيچه و همين طور پروتئين بافتهاي پيوندي (نظير كولاژن)مي گردند.
پاپائين Papain ، فيسين Ficin , بروملائين Bromelain و اكتينيدين Actinidin :اين آنزيمها داراي ريشه گياهي هستند و به ترتيب از ميوه درخت پاپايا (كه كاملا رسيده نباشد)، از لاتكس Latex انجير (شيره سفيد رنگ مترشحه از درخت) , از ميوه و ساقه درخت آناناس و از ميوه كيوي Kiwi بدست مي آيد .محل فعال اين آنزيمها داراي يك سيستئين و يك هيستيدين است كه براي فعاليت آنها ضروري مي باشند.PH مناسب براي اينها 5/7 – 6 است.اين آنزيمها پيوندهاي پپتيدي ، استري و آميدي را هيدروليز مي كنند.
پاپائين از يك زنجيره واحد پلي پپتيدي با 212 اسيد آمينه تشكيل شده است.انجام عمل كاتاليزوري اين آنزيم در دو مرحله صورت مي گيرد .در مرحله اول آسيله شدن Acylation است كه طي آن يك تركيب حد واسط آنزيم – اسيل توليد مي گردد.در مرحله دوم عمل جدا شدن قسمت حاوي اسيل Deacylation از آنزيم كه با هيدروليز تركيب حد واسط و توليد يك محصول همراه مي باشد ، انجام مي شود.در مورد پاپائين اختصاصي عمل كردن چندان مشاهده نمي شود.علت آن اين است كه محل فعال اين آنزيم از هفت واحد يا قسمت فرعي تشكيل شده است ؛ از اين نظر مي تواند سوبستراي مختلفي را به خود بگيرد.
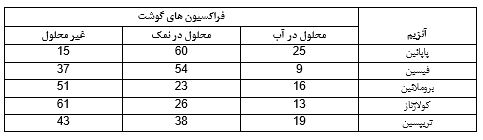
يكي از مهمترين كاربردهاي اين گروه از آنزيمها استفاده از آنها براي ترد كردن گوشت است.اين عمل مي تواند از طريق تزريق آنزيم به داخل لاشه يا ماليدن روي تكه هاي گوشت انجام كيرد.البته حالت تزريق ممكن است با مسائلي همراه باشد.زيرا در اين حالت امكان دارد بخشي از گوشت خيلي زياد ترد شود در حالي كه قسمتهاي ديگر از تردي لازم و مورد نظر بي بهره بمانند.به طور كلي اثر مطلوب اين آنزيمها در مورد گوشت ناشي از تجزيه و محلول ساختن پروتئينهاي آن مي باشد.در جدول 2 ميزان فراكسيون محلول گوشت كه تحت اثر بعضي از پروتئازها قرار گرفته اند نشان داده شده است
جدول 4- ميزان فراكسيون محلول گوشت كه تحت اثر بعضي از پروتئازها قرار گرفته اند
در ميان پروتئازها ، گروهي نيز وجود دارند كه براي فعاليت خود نيازمند به يك فلز به عنوان كوفاكتور مي باشند .اينها جزء گروه اگزوپپتيدازها و شامل كربوكسي پپتيدازها و آمينوپپتيدازها هستند. بديهي است وجود عوامل تشكيل دهنده كمپلكس با فلزات مي تواند از اثر اين آنزيمها جلوگيري كند .
ليپاز ها و انواع آن ها
ليپازها انواع مختلفي دارند و سبب شكسته شدن پيوندهاي استري ميان گروههاي الكلي و اسيدي مي گردند .ويژگي خاص ليپازها در اين است كه اساسا در سطح ميان امولسيون آب و چربي اثر خود را ظاهر مي سازد.به اين ترتيب هر عملي و يا شرايطي كه باعث افزايش سطح ميان آب و چربي در يك سيستم امولسيوني شود ، افزايش فعاليت ليپاز را به همراه دارد.به همين دليل است كه فعاليت ليپاز در شير همگن شده ولي پاستوريزه نشده نسبت به شير خام همگن نشده به مراتب بيشتر مي باشد.
ليپازها را مي توان با استفاده از بعضي باكتريها ، كپكها و گياهان توليد كرد.در عالم حيواني اين آنزيمها در پانكراس و شير يافت مي شود.وجود ليپاز در شير طبيعتا مي تواند سبب جدا شدن اسيدهاي چرب از قسمت گليسريدي ملكول شود كه با توجه به فراريت بسياري از اين اسيدها ، مي توان يك حالت تندي و ترشيدگي را در شير مشاهده كرد.اگر چه در اين حالت نقش ليپاز نامطلوب و مخرب است اما در مواردي كه شامل توليد برخي پنيرها مي شود ، آزاد شدن اسيد چرب مطلوب و مورد نظر است زيرا به ايجاد طعم خاصي در چنين پنيرهايي كمك مي كند .مثلا در پنير آبي Blue Cheese مقدار اسيد چرب آزاد ممكن است تا 60 گرم در يك كيلو از اين پنير برسد كه ناشي از فعاليت پني سيليوم روكوفورتي Penicillium roqueforti و پني سيليوم كاممبرتي Penicillium Camemberti مي باشد.
در دانه هاي روغني هميشه يك مقدار فعاليت ليپاز وجود دارد به طوري كه در روغن اين دانه ها حداقل 5/0 درصد اسيد چرب آزاد مشاهده مي شود .در روغن پالم و همين طور روغن سبوس برنج و يولاف ليپازهاي بسيار فعالي هستند كه چنانچه سريعا غير فعال نشوند به سرعت سبب افزايش اسيد چرب آزاد در اين روغنها مي گردند.در صورتي كه اين افزايش از حدي تجاوز نمايد ديگر روغن براي مصارف غذايي مناسب نيست(چون تصفيه آن پر هزينه و با افت زياد همراه است)كه در چنين حالتي بايد در مواردي چون صابون سازي از آن استفاده شود.در چربيهاي حيواني فعاليت ليپاز در خور توجه نمي باشد و در انواع خوب اين چربيها تقريبا اسيد چرب آزاد مشاهده نمي شود.به طور كلي فعاليت ليپازها بستگي به شرايط رطوبتي محيط دارد.مثلا در گندم با رطوبت حدود 15 درصد نسبت به زماني كه رطوبت گندم 8/8 درصد باشد ميزان فعاليت اين آنزيم 5 مرتبه بيشتر است.
بعضي از ليپازها به طور اختصاصي عمل مي كنند كه يك نمونه از آن نحوه اثر فسفوليپازهاي مختلف است كه در ابتداي بحث آنزيمها به آن اشاره شد.ليپاز پانكراس ترجيحا اسيدهاي چرب قرار گرفته در موقعيتهاي 1 و 3 گليسريد را مي شكند كه به اين ترتيب محصول نهايي آن بايد 2 – منوگليسريد باشد.از اين ويژگي ليپاز پانكراس براي شناسايي اسيد چرب قرار گرفته در موقعيت 2 گليسريد مي توان استفاده كرد .اما در مواردي ممكن است همين اسيد چرب موقعيت 2 نيز شكسته شود و حدود 2 – 1 درصد گليسرول در محيط ظاهر گردد .نحوه اثر ليپاز پانكراس روي تري گليسريد به صورت زير مي باشد(R نمايانگر اسيد چرب متصل به گليسرول است.)
بايد توجه داشت كه عمل ليپاز صرفا جداكردن اسيد چرب نيست.زيرا تحت شرايط خاصي ممكن است ليپاز عمل استري كردن يعني متصل نمودن اسيد چرب به گليسرول را انجام دهد.
منابع مورد استفاده جهت دسترسي به اطلاعات بيشتر
- افشار ، نادر ، رجب ، ابوالفضل ، 1379 ، “كاربرد آنزيمها در تغذيه طيور” انتشارات نور بخش
- فاطمي ، حسن ، 1378 ،” شيمي مواد غذايي” ، شركت سهامي انتشار
- فرزامي ، بيژن ، 1368 ،” آنز يم ها” ، انتشارات بخش فرهنگي دفتر مركزي جهاد كشاورزي قنبرزاده ، بابك ، 1378 “شيمي مواد غذايي” ، نشر پارس نگار
- Amylase, Alpha ,http://www.worthington-biochem.com/manual
- Amylase, Beta, http://www.worthington-biochem.com/manual
- Better Bread with New Enzyme, http: // www.danisco.com/press
- Eating Smart — Kiwi Capers, http://cancerresourcecenter .com/ articles/
- Enzyme Preparation,http://vm.cfsan.fda.gov/~dms/opa-cg7.html
- Food Enzyme Deficiencies:The Hidden Causes of Chronic Complaints, http://www.loomisenzymes.com/
- Naturally Occurring Ribozymes , http://www.ribs.org/biosciencelibrary/
- Properties of Actinidin, http://www.food-allergens.de/symposium-vol1(1)/data/kiwi/actc1.htm
- The Food Enzyme Concept, http://home.istar.ca/~collins /enzyme article
گرد آورنده : گروه مترجم ایران سهند
نوشته شده در تیم تحریریه ایران سهند
شما هم میتوانید مطالب خودتون رو در بخش وبلاگ ایران سهند منتشر کنید!
- مقالات شما به صورت کاملا رایگان در این بخش منتشر خواهد شد
- البته مقالاتی پذیرفته می شود که مرتبط با موضوع فعالیت این وب سایت باشد.
- همچنین ویراستاران ایران سهند در صورت لزوم مقالات شما را از نظر نگارشی و سئو اصلاح خواهند کرد.
- برای اطلاعات بیشتر کلیک کنید
شاید این مطالب هم برایتان جذاب باشد!
8
اردیبهشت
1401
27
اردیبهشت
1401
11
اردیبهشت
1401
22
تیر
1401
20
اردیبهشت
1401
ممنون از وقتی که برای مطالعه این مطلب گذاشتید؛
در صورتی که قصد خرید یا آشنایی با انواع محصولات مورد نیاز در صنعت مرغداری را دارید میتوانید از طریق دسته بندی های زیر مشخصات کامل این محصولات را مشاهده و خربد کنید
برخی از دسته بندی های محصولات فروشگاه ایران سهند
دیدگاه های تبلیغاتی و غیر مرتبط تایید نخواهد شد
صرفا به زبان فارسی دیدگاه خود را ثبت کنید
Advertising and unrelated comments will not be approved
Register your opinion only in Farsi language